Hace casi 50 años, dos científicos costarricenses hicieron historia a nivel internacional por descubrir el causante de un padecimiento inexplicable y de síntomas confusos. El aporte de ambos fue tan trascendental para la salud humana de Costa Rica y el mundo, que la prestigiosa revista Parasites & Vectors decidió, este 2021, conmemorar el hallazgo realizado en suelo tico.
Le hablamos de Angiostrongylus costaricensis, el parásito responsable de esa enfermedad tan misteriosa y cuyo padecimiento (que incluso hoy continúa enfermando a algunas personas) se conocería luego como angiostrongiliasis abdominal.
¿Los nombres de las grandes mentes científicas detrás del hallazgo? El Dr. Pedro Morera y el Dr. Rodolfo Céspedes, de la Facultad de Microbiología de la Universidad de Costa Rica (UCR) y de la Caja Costarricense de Seguro Social (CCSS), respectivamente.
El talento de los dos permitió que por primera vez, en 1971, médicos y científicos a nivel mundial tuvieran una explicación, y que la enfermedad (caracterizada por el dolor abdominal severo, fiebre y hasta la anorexia) dejara de confundirse con otros padecimientos. ¿El más común? Apendicitis.
“El Dr. Filipe Dantas-Torres, brasileño y editor general de la Revista, se mostró muy entusiasmado en conmemorar el aniversario del descubrimiento porque, al igual que en Costa Rica, Brasil ha tenido muchos casos por causa de este parásito y todavía hoy se siguen presentando. Esto ha sido a tal medida que varios investigadores brasileños han dedicado sus carreras al estudio del Angiostrongylus costaricensis”, comentó la Dra. Alicia Rojas Araya, docente e investigadora de la Sección de Helmintología Médica de la Facultad de Microbiología de la UCR.
El comienzo
Pero, ¿cómo inició todo? Echemos un vistazo a 1952, fecha en la que se registró el primer caso costarricense de angiostrongiliasis abdominal en humanos. El afectado era un niño de siete años que sufría de dolor abdominal severo y tenía engrosamiento en una parte del intestino.
Aunque en ese momento no se sabía que era por causa de un parásito y, aún menos de Angiostrongylus costaricensis, los médicos realizaron una cirugía que consistía en cortar y extraer parte del intestino afectado.
El niño se recuperó por completo, según se constata en los archivos. Sin embargo, en los próximos 16 años, la CCSS seguiría recibiendo casos con las mismas manifestaciones clínicas.
De acuerdo con la publicación científica en Parasites & Vectors, cerca de 63 casos similares fueron recibidos en el Hospital San Juan de Dios. ¿Las principales víctimas? Niños y niñas en edad escolar, una población altamente vulnerable y que, por lo tanto, exigía una explicación.
“En 1968 se empieza a dar una asociación con que los casos eran provocados por la presencia de un gusano, un nemátodo. Pero en ese momento tampoco llegaron a identificar específicamente qué era. Fue hasta en 1971, cuando el Dr. Pedro Morera, con el Dr. Rodolfo Céspedes del Hospital San Juan de Dios, concluyeron que todos estos casos sin resolver tenían un agente etiológico común. Las investigaciones avanzaron y ellos pudieron vincularlo con éxito a un nemátodo parecido a otros que causaban cuadros clínicos similares en el continente americano y asiático”, amplió la Dra. Rojas.
A partir del descubrimiento, Costa Rica tenía una respuesta y los científicos ticos se dedicaron a ayudar y a describir ese mismo parásito en otros países como Brasil, Honduras, Argentina, algunas partes del Caribe y, años después, al resto del continente Americano. Al día de hoy, Angiostrongylus costaricensis se ha identificado en 24 sitios geográficos.
Contagio
Tal vez ahora la pregunta más importante que usted tenga es: ¿y cómo ese parásito llega al ser humano? Quizá le alegre saber que sus manifestaciones no ocurren de la noche a la mañana. Su proceso lleva tiempo y para contraerlo se necesita consumirlo de forma directa.
Debido a esto y a la fuerte respuesta inflamatoria que se produce contra el parásito, al ser humano se le llama hospedero accidental. Entonces, ¿por qué algunos se infectan? Para contestar esta pregunta primero hay que entender el ciclo de vida del parásito.
El A. costaricensis tiene un desarrollo muy complejo y requiere de varios animales hospederos para desarrollarse. Los más frecuentes son los caracoles (como las babosas) y los roedores. Estos últimos son sus hospederos naturales más importantes.
Las especies de roedores son los organismos preferidos por el nemátodo para crecer favorablemente y salir al ambiente por sus heces. El excremento, al estar en el entorno, es cuando los otros hospederos intermediarios (caracoles y babosas, por ejemplo) toman las formas infectantes del parásito y lo portan hasta que el siguiente hospedero lo tome. Aquí entra el ser humano.
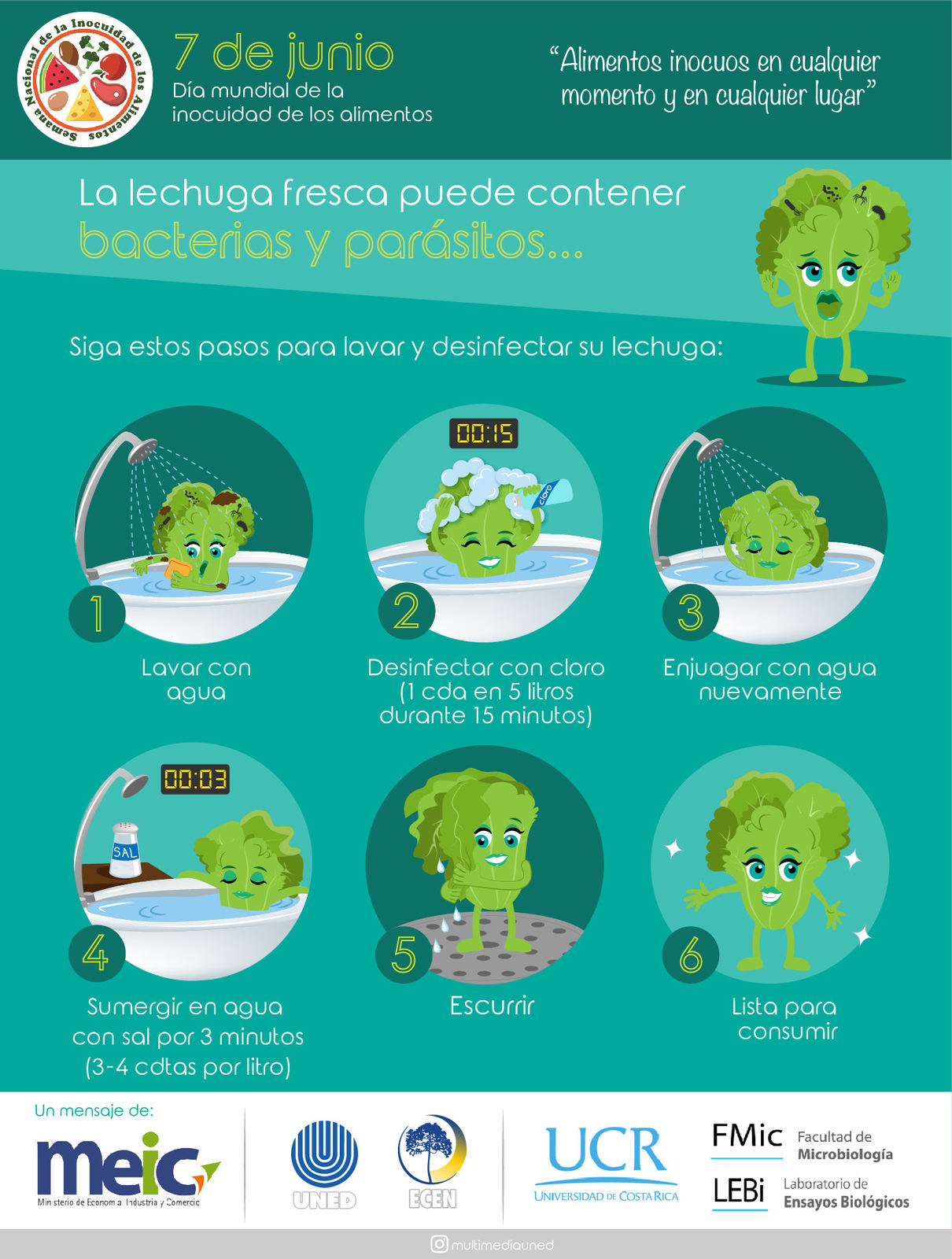
El parásito llega a la persona cuando alguno de esos animales entra en contacto con los alimentos a consumir. ¿El ejemplo más sencillo? Una lechuga mal lavada en la que pasó una babosa portadora del parásito, la cual dejó sus secreciones (baba) y, claramente, las larvas del A. costaricensis.
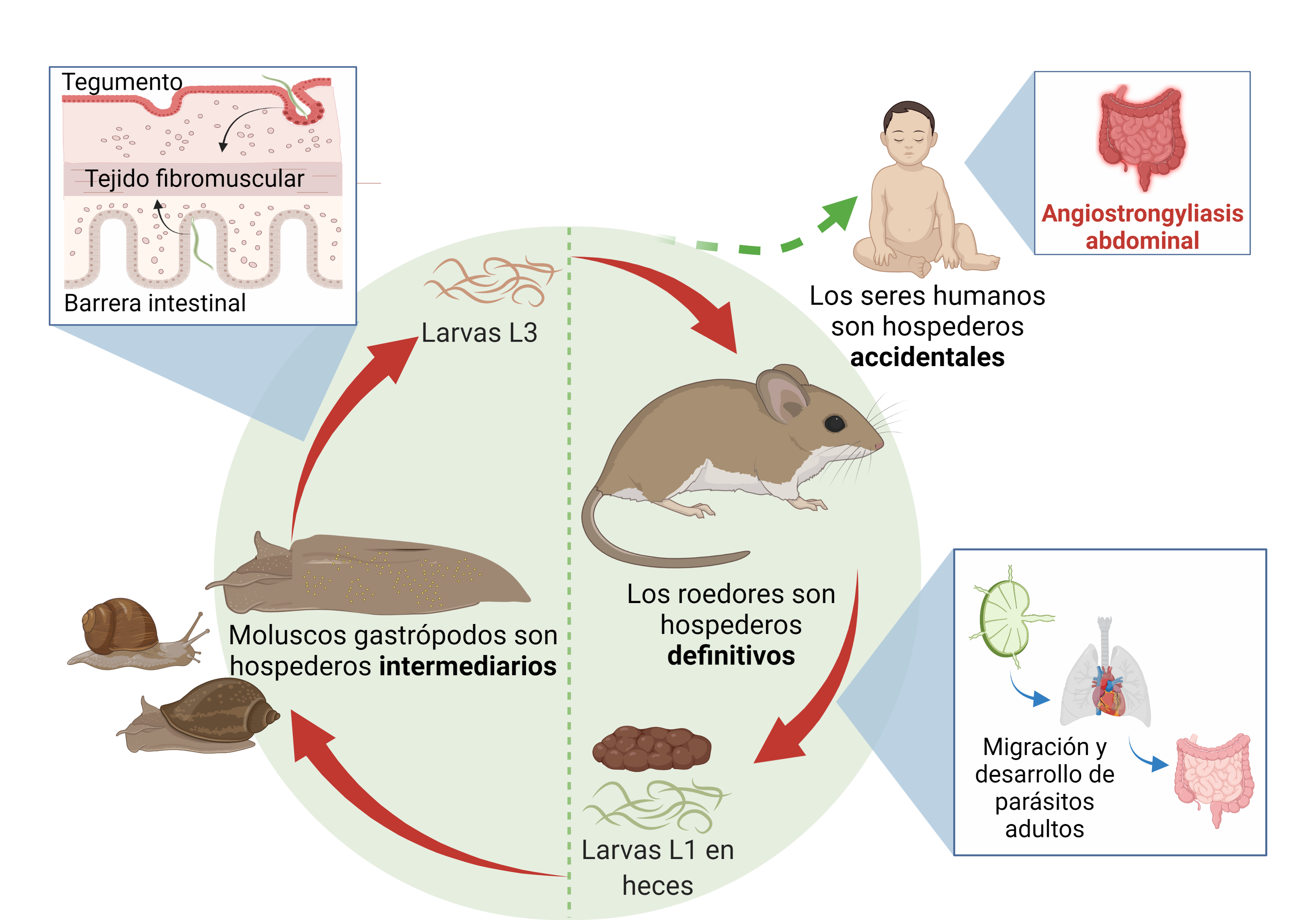
En la infografía de Trends in Parasitology se encuentra el ciclo de vida del A. costaricensis que inicia con el huevecillo, luego se desarrolla en cuatro estadíos larvales hasta llegar a su fase adulta. Los seres humanos se consideran huéspedes accidentales o sin salida de A. costaricensis, pues los huevecillos o L1 no se liberan en las heces.
“El ser humano contrae el parásito cuando ingiere las larvas que están en su tercer estadío. Hay varios estadíos, pero solo las de la tercera etapa de desarrollo son infectantes para nosotros. Estas se pueden adquirir por el consumo de la babosa o por la baba que deja, porque ahí se quedan las larvas. Por eso es muy importante el correcto lavado de los vegetales”, explicó el Dr. Alberto Solano Barquero, Biólogo y Médico de la UCR.
Otra forma de infección en el ser humano es el consumo de las babosas o caracoles que porten el parásito. Asimismo, se pueden encontrar ocasionalmente en animales como las ranas y los sapos.
“Una vez que se da la ingesta, el parásito se libera e inicia un camino muy largo dentro del cuerpo hasta llegar a las arterias del intestino y ahí empieza a liberar huevecillos. Un aspecto muy importante es que el ser humano no es un hospedero natural. Mientras el roedor genera una respuesta inmune muy leve, el cuerpo de una persona sí produce una respuesta inflamatoria muy fuerte contra los huevecillos que se están intentado liberar al intestino. Esto es lo que produce las manifestaciones clínicas”, aclaró la Dra. Rojas.
Guerra inmunológica
Si la larva está en el organismo, esta inicia una migración compleja en el cuerpo de la persona. Este ágil enemigo pasa por los vasos linfáticos, llega a la vía venosa y luego a los vasos mesentéricos, grandes encargados de irrigar el intestino.
Durante la migración, el parásito hace un tipo de “muda” que le permite crecer y madurar. Al llegar a las arterias mesentéricas, las larvas se convierten en adultos, copulan e inician su reproducción.
“El cuerpo va a generar una reacción inflamatoria y, los huevecillos del parásito, pueden experimentar dos escenarios: quedar atrapados en los vasos o salir al tejido del intestino. En las biopsias se suele encontrar una cantidad importante de células inflamatorias infiltradas al rededor de las arterias afectadas por el nemátodo, los huevecillos y las larvas”, comentó el Dr. Solano.
La afectación inflamatoria alrededor de los vasos sanguíneos es lo que se traduce en síntomas de dolor abdominal. A mayor cantidad de huevecillos y larvas atrapadas, más fuerte será la inflamación. Esta puede ser severa, ocasionar microtrombos, obstrucciones, alteraciones en los tejidos similar a la enfermedad de Crohn, así como engrosamiento del intestino o fibrosis.
Para el Dr. Javier Mora Rodríguez, docente e investigador de la Sección de Helmintología Médica de la Facultad de Microbiología, la exacerbación de la respuesta inflamatoria es el intento desesperado que hace el organismo para deshacerse del parásito. Sin embargo, no lo logra y, en vez de causar un bien, da pie a una inflamación que afecta los tejidos de una forma peor que el mismo agente infeccioso como tal.
“El proceso inmunológico que se da es el centro de la patología. Hay una serie de barreras inmunológicas que llevan a una inflamación severa tipo 2, característico de los nemátodos. Por lo tanto, más que la presencia del parásito, la enfermedad es mediada por la respuesta inmunológica que se genera. Eso hace que sea difícil de tratar, que se confunda con otras enfermedades y que se requiera un diagnóstico diferencial”, expuso el Dr. Mora.
En cualquier caso, el daño al tejido puede ser grave y comprometer la función sanguínea a otros sectores del cuerpo.
“En el momento en que la inflamación sucede, los dolores intestinales son más fuertes. En ocasiones, hasta es necesario realizar una intervención quirúrgica para salvar el intestino, resecar las zonas afectadas por el daño generado al tejido necrótico (muerte del tejido) o isquémico (reducción del flujo sanguíneo) que llevaría a un cuadro clínico más severo”, aseveró el Dr. Solano.
Aún falta conocer más sobre el mecanismo inmunológico de este parásito, por lo que se abordará en otros proyectos. Desde la UCR ya se ha empezado a sacar nuevas líneas de investigación relacionadas con los hospederos intermediarios. Para el próximo año se estudiará su material genético así como su respuesta inmune.
Prevención
Los parásitos buscan dañar lo menos posibles a su hospedero, pues no les sirve despertar un proceso inmunológico muy severo que los elimine.
Por eso, a nivel evolutivo, estos minúsculos seres han desarrollado mecanismos orientados a mantener el equilibrio. Lamentablemente, eso no ha pasado con A. costaricensis en los seres humanos y por eso es vital la prevención.
En la actualidad, no hay un tratamiento para el angiostrongiliasis abdominal que sea el estándar de oro. El Dr. Solano es claro al indicar que la respuesta inflamatoria dificulta su intervención. De igual manera, el tratarla con antiparasitarios puede incentivar a las lavas a migrar a otros órganos, lo que complicaría el escenario.
“Cuando se identifica a una persona con el parásito, lo que se procede es a vigilar, intervenir el dolor, la inflamación, dar soporte y proporcionar intervención quirúrgica si se necesita. Por eso, el mejor tratamiento es la prevención y la vigilancia del ambiente. Que no haya babosas o moluscos, porque muchos de los casos en los que niños se han complicado es por una ingesta accidental”, declaró el médico.
Debido a su alta presencia en el país, a este parásito se le considera como endémico. Se estima que la incubación en humanos puede ser de tres semanas a varios meses.
La mejor forma de contrarrestarlo es con un buen lavado de las verduras y alimentos, a fin de eliminar cualquier rastro de secreción dejado por las babosas y caracoles, principalmente.
Consulte la publicación conmemorativa de Parasites & Vectors al hacer clic aquí.

Periodista, Oficina de Divulgación e Información
Área de cobertura: ciencias de la salud
jenniffer.jifjermenezcordoba @ucrrtim.ac.cr
Comentarios:
Artículos Similares:
-
 Hace 50 años, un microscopio electrónico cambió para siempre cómo Costa Rica vería la ciencia
Hace 50 años, un microscopio electrónico cambió para siempre cómo Costa Rica vería la ciencia -
 La UCR está lista para brindar diagnósticos a pacientes con cáncer de la CCSS, pero no puede empezar
La UCR está lista para brindar diagnósticos a pacientes con cáncer de la CCSS, pero no puede empezar -
 La UCR conmemoró 50 años de su Acción Social
La UCR conmemoró 50 años de su Acción Social -
 Científico exalta el talento tico en España por estudio que mejoraría el impacto de la terapia renal
Científico exalta el talento tico en España por estudio que mejoraría el impacto de la terapia renal