Ella es la costarricense detrás del primer método mundial para restaurar la visión
Marcela Garita Hernández es una farmacéutica que, con tan solo 23 años, salió del país con un firme objetivo: ampliar su formación en terapia celular. Hoy, esa educación es sinónimo de esperanza para aquellos que, por sus patologías genéticas, han perdido el sentido de la visión.
Esta tica, graduada en el 2002 de la Facultad de Farmacia de la Universidad de Costa Rica (UCR), no solo enaltece a nivel mundial a todo un pueblo, sino que también deja en alto la capacidad científica de la mujer costarricense.
En sus años de estudio, y de manera sobresaliente, la Dra. Garita se graduó de la UCR con honores. Posteriormente, logró una Maestría en Investigación Biomédica, así como un Doctorado en Terapia Celular y Medicina Regenerativa. Ambos títulos fueron obtenidos en la Universidad de Sevilla, España, con la distinción Cum Laude; es decir, con promedio sobresaliente.
Por lo tanto, si hay elementos que caracterizan a Marcela son su tenacidad, perseverancia, coraje, así como un fuerte conocimiento científico, mismo que le permitieron enfrentarse de forma exitosa a un área históricamente dominada por hombres. En este caso particular, por físicos, biólogos e ingenieros.
El esfuerzo constante de la Dra. Garita, junto con otros ocho especialistas internacionales, dio vida a una terapia única que promete restaurar la visión mediante el uso de células madre y la optogenética ―proceso usado para transferir el ADN de una proteína e introducirla en la célula de interés―.
En términos más sencillos, lo que el tratamiento propone es remplazar las células muertas encargadas de captar la señal luminosa, conocidas como fotorreceptores, por células funcionales capaces transformar esa señal en un vínculo eléctrico para el cerebro. Si bien, el método requiere de otras etapas de validación para finalmente aplicarse al paciente, el tratamiento avanza de manera alentadora con un gran apoyo del Gobierno francés.
La Dra. Garita, oriunda del cantón de Guadalupe, San José, e integrante de uno de los principales grupos de investigación en el Instituto de Neurociencias de la Universidad de Montpellier, brindó unos minutos para explicar en qué consiste la potencial terapia que fue patentada en Europa a inicios del 2019 y desarrollada en el Instituto de la Visión en Francia.
Asimismo, indicó el estado actual del proyecto, los retos por superar y dejó entrever sus motivaciones, desafíos y aspiraciones ante una solución, con esencia UCR, que en un futuro podría revolucionar la salud de casi 1.5 millones de personas en el mundo que actualmente carecen del sentido visual por retinosis pigmentaria. Esta enfermedad es la primera causa de ceguera en la población adulta y es más frecuente en hombres, según lo publicó un artículo científico de la Pontificia Universidad Católica de Valparaíso en el 2013.
En el video se observa parte del trabajo de la Dra. Garita con células madre.
El inicio
–Dra. Garita, su formación en Costa Rica fue dada por instituciones públicas. Primero, en el Liceo Rodrigo Facio y luego en la UCR. ¿En algún momento pensó integrar un equipo científico tan diverso e impulsar un método revolucionario a nivel mundial que promete restaurar la visión de una persona que carece de ese sentido?
Marcela Garita Hernández (MGH): "Nunca lo imaginé. Cuando colaboraba como estudiante en el Laboratorio de Análisis Cuantitativo Farmacéutico de la UCR, con la Dra. María Monge, no pensé que acabaría haciendo células con la posibilidad de implantarse en la retina de un paciente. Esto es algo que estaba muy fuera de mi zona de confort cuando estaba estudiando farmacia e, incluso, después de graduada".
Pero es, precisamente, ser un outsider en ese mundo de biólogos, físicos e ingenieros, que me dio la posibilidad de ver las cosas distintas y dar un aporte diferente.
–Al realizar una revisión de distintos artículos científicos publicados sobre esta área, se nota que históricamente ha sido un campo dominado por los hombres. En otras palabras, es la primera vez que alguien del área de farmacia, de origen latinoamericano y mujer, promueve un proceso como el de implantar células en la retina para recobrar la visión. ¿En qué momento de su carrera es que, por primera vez, se le despierta ese interés por la terapia celular?
–MGH: "Fue en 1997, con el clonamiento de la oveja Dolly. En segundo año de la carrera de Farmacia fui a Estados Unidos en un intercambio académico. En una clase de bioquímica, se habló de un artículo que marcó un antes y un después en la terapia celular, solo que entonces no lo sabíamos. Era un artículo de Nature que recogía cómo descendientes viables, derivados de una célula fetal y una célula adulta de mamíferos podían obtenerse".
El Dr. Ian Wilmut, del Instituto Roslin, clonó a la oveja Dolly mediante una técnica que se le conoce como transferencia nuclear. La técnica consiste en fusionar un óvulo de oveja, con una célula mamaria adulta. Posteriormente, se implantaron estos híbridos resultantes en una madre subrogada. Después de eso, los investigadores especulaban qué híbridos similares, hechos por células embrionarias humanas o células adultas de un individuo, podían ser usadas para crear tejidos y órganos genéricamente compatibles.
Tan solo un año después, en la Universidad de Wisconsin Madison y en el Johns Hopkins de Baltimore, se aislaron las primeras líneas celulares embrionarias humanas. Ese hallazgo me pilló muy lejos y ya estaba descubriendo otros amores entre las aulas de farmacología y toxicología. Sin embargo, fue cuando inicié la maestría en bioquímica de la Facultad de Medicina de la UCR, que me volvió a picar esa curiosidad de estudiar biología celular.
–¿Cuándo y por qué decide ir a España para especializarse en esa área?
–MGH: "Yo quería un doctorado. Los Estados Unidos era una buena opción. Sin embargo, en el 2001, el presidente Bush cambió un poco los planes. Él prohibió la investigación con células madre. Más que todo, por cuestionamientos éticos".
Solo Gran Bretaña había dado un paso al frente para regular la investigación en dicho campo, pero tan solo una maestría era superior a los $10 000 anuales, lo cual no podía costear. Cuando pensaba que llegaba tarde a mi cita con las células madre, terminé siendo técnico de Laboratorio para el equipo del Dr. Bernat Soria en Andalucía, España. Eso me dio la oportunidad de realizar mi tesis de maestría en el equipo de José López Bameo, donde desarrollé neuronas dopaminérgicas ―neuronas que transmiten dopamina de una región del cerebro a otra― a partir de células madre.
–¿Y por qué enfocarse en células madre?
–MGH: "Una célula madre se caracteriza por dos principales propiedades: la primera es la autorenovación. Esto quiere decir que se puede autoreplicar en dos células completamente idénticas".
La segunda es la pluripotencia, que es su característica más interesante. Significa que estas células pueden dar origen a todas las demás encargadas de formar 200 tipos de tejido distintos. En otras palabras, dar origen a las células de las tres distintas capas germinales (conjunto de células generadas en el desarrollo embrionario que darán origen a los tejidos y a los órganos).
El ectodermo, en concreto, es la capa germinal durante el desarrollo embrionario que da origen al cerebro y a la retina.
–Ahora bien, ¿cuándo es que usted empieza a pensar que podría existir un vínculo entre las células madre y la visión?
–MGH: "Durante la defensa de mi maestría. Un miembro de mi jurado me recomendó seguir el doctorado. Era un investigador del University College of London, el Dr Shomi Bhattachanya, quien se convirtió en mi mentor y en mi papá de ciencias".
Yo fui a la entrevista y el Dr. Bhattachanya, reconocida figura en genética de retina, me llamó a la entrevista y me dijo: ¿podrías hacer células fotorreceptoras en lugar de neuronas dopaminérgicas? Yo le dije que si y que en uño se las tenía listas. El problema es que nadie lo había hecho antes.
–¿Qué se pretendía con esa investigación, aparte de lograr su doctorado?
–MGH: "Era fácil. Yo tenía que coger células madre, diferenciarlas a fotorreceptores, concretamente a bastones (utilizados por el ojo para adaptarnos a la oscuridad y para la visión periférica). Lo que queríamos era trasplantarlos a ratones. Eso significaba que debían ser células positivas para una proteína conocida como rodopsina, que es un marcador específico de los bastones y es una proteína necesaria para incentivar la visión normal".
–¿De qué manera ese proceso de tomar células madre y diferenciarlas a fotorreceptores iba a colaborar con el método de restauración visual?
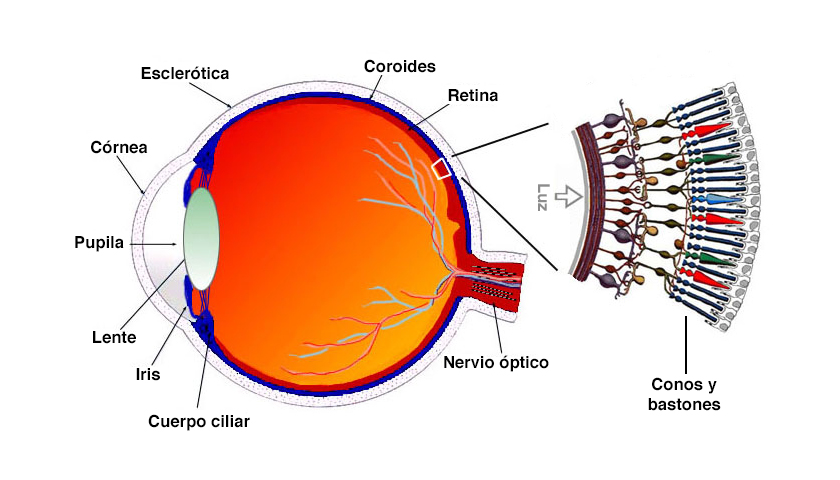
–MGH: "La retina es un tejido que se encuentra en la parte trasera del globo ocular y está constituida por células fotorreceptoras. Estas células interactúan muy cercanamente con las interneuronas, encargadas de trasmitir la señal a las células ganglionares. Los axones de las células ganglionares forman el nervio óptico que trasmiten el pulso nervioso al cerebro, concretamente, en la corteza visual para que nosotros podamos ver".
Hay dos tipos de células fotorreceptoras que son las únicas dos neuronas en toda la retina que son sensibles a la luz: los bastones y los conos. Estos últimos son los responsables de la visión a color y la agudeza visual; y su deterioro conlleva a la pérdida de la visión central y a la devastadora ceguera completa.
Anatomía del ojo
Publicación inesperada
–¿Cuál fue el proceso que desarrolló en la maestría, el cual le dio los insumos futuros para que ya, en el Instituto de la Visión en París, se concretara la innovación?
–MGH: "Yo imitaba condiciones de retinogénesis (desarrollo de la retina) que sucedían en la gestación de un embrión de ratón. Nunca había sido tan feliz. Un día muy tarde en el instituto, después de un año, encontré células positivas para rodopsina en mis pequeñas placas de cultivo y, además, eran positivas para otro marcador de fotorreceptores. Este marcador era también aplicable para los conos y los bastones. ¡Yo estaba que saltaba! No solo tenía los bastones que quería el Dr. Shomi Bhattachanya, sino también los conos".
–No obstante, usted y su grupo de investigación tuvo que innovar. El estudio dio un giro inesperado.
–MGH: "Sí. Japón, el único lugar que nunca se cuestionó si era o no era ético trabajar con células madre, llevaba una década antes que yo intentando obtener fotorreceptores. A una escasa semana que me duró la fiesta de las rodopsinas positivas, salió una publicación de altísimo impacto, en el que no solo tenían bastones y conos a partir de células embrionarias de ratón, al igual que yo, sino que también lo tenían en monos y células embrionarias humanas".
–¿Qué se hizo entonces?
–MGH: "Nos enfocamos en estudiar la influencia del oxígeno: la hipoxia. Tres años después, encontramos que había un efecto beneficioso al usar la hipoxia para diferenciar las células a fotorreceptores. Terminamos siendo uno de los primeros grupos que trasplantaron las células en ratones sanos".
Primer contacto con pacientes
–Posteriormente, usted se mueve a París, al Instituto de la Visión. En ese lugar, por fin, se concreta el método.
–MGH: "El Dr. Oliver Goureau me llevó a París. Empecé a trabajar en la transformación genética de pequeñas retinas in vitro. El objetivo de mi trabajo era la restauración de la visión con un método de terapia celular".
En ese mismo año, en el 2012, al Dr. Shinya Yamanaka le otorgan un premio novel por una tecnología que se llama reprogramación celular. Él descubre que introducir cuatro factores de transcripción en una célula somática, bastaba para convertirla en una célula pluripotente: las famosas IPS.
Además, demuestra que estas IPS son idénticas a nivel genético y morfológico a las controversiales células madre embrionarias. Ese descubrimiento nos permitió aislar células de pacientes mediante biopsias. Luego, reprogramamos esas células de las personas a células pluripotentes; las expandíamos in vitro y las congelábamos.
–Pero a ustedes aún les faltaba algo. Es aquí cuando aparecen los organoides; es decir, órganos de retina en miniatura desarrollados en laboratorio. ¿Qué buscaban con eso?
–MGH: "Las distrofias en la retina son las causas de la ceguera irreversible en todo el mundo y se caracteriza por la pérdida progresiva por las células fotorreceptoras. Al principio se tienen muchos enfoques terapéuticos porque todavía tenemos algo de fotorreceptores. Así, los pacientes se pueden beneficiar de terapias como la terapia génica, la farmacoterapia o la neuroprotección. El problema es que ninguno de esos tratamientos es capaz de revertir la enfermedad".
El perfeccionamiento de las técnicas de diferenciación llevó a muchos grupos a desarrollar el modelo de organoides. Actualmente, se han identificado organoides de riñón, estómago y cerebro. La retina no es una excepción. Nosotros, concretamente, hemos desarrollado un protocolo para obtener organoides de retina más corto que lo usual, y hemos descubierto que tienen una capa bastante abundante de fotorreceptores.
De esta forma, se puede generar organoides de retina con una alta concentración de conos en ella. El problema es que ni nosotros, ni nadie, podía obtener una estructura muy importante para que estos conos sean funcionales: el segmento externo. Tampoco, se podía obtener otra capa muy importante para que los fotorreceptores pudieran funcionar.
Aquí, específicamente, es donde entra la optogenética a través del proyecto OptoStem, que reunió los esfuerzos y recursos de tres grupos de investigación liderados por Oliver Goureau, Jens Duebel y Deniz Dalkara.
–¿Qué se quería con el proyecto OptoStem? ¿Era, precisamente, superar ese inconveniente de los organoides?
–MGH: "Si. El proyecto planteaba que si los organoides de retina no eran lo suficientemente idóneos para poder estudiar el desarrollo de conos o la terapia celular de reemplazo, lo que teníamos que hacer era ingeniería genética: la optogenética".
La optogenética, usado mucho en neurociencias, utiliza proteínas fotosensibles que se abren y se cierran a partir de estímulos luminosos. Estas proteínas provienen de microorganismos como las bacterias. De esos microorganismos aislamos el ADN que codifica la proteína fotosensible, la trasplantamos y la introducimos en el núcleo de una neurona. Como consecuencia de esta alteración genética, la neurona va a utilizar su propia maquinaria celular y, al hacer esto de la mano con un estímulo de luz apropiado, vamos a poder activar esa neurona.
Entonces, nos preguntamos, si la optogenética activa o inhibe neuronas utilizando estímulos luminosos, ¿por qué no podríamos utilizarla para hacer que nuestros fotoreceptores sean sensibles a la luz? Nosotros decidimos hacerlo. Tomamos el ADN, lo introdujimos en nuestros conos no funcionales, sin segmento externo, y los estimulamos con una luz en una longitud de onda apropiada. Vimos que obteníamos una potencial acción: nuestros fotorreceptores respondían a la luz.
Esencia femenina
Los traficantes de ADN
–Como usted lo explicó, la optogenética utiliza proteínas fotosensibles, extraídas del ADN de microorganismos, que son introducidas en los conos no funcionales. ¿Cómo es que logran que la proteína sea insertada?
–MGH: "Mediante vectores virales. Un vector viral es un traficante de ADN, es algo que nosotros simplemente utilizamos para transferir ADN a una célula. La mayor parte del tiempo son virus".
Nosotros necesitábamos el mejor vector viral, un promotor lo suficientemente específico para que solamente infectara las células que nos interesaban: los conos. También, afinar la dosis, porque llega un momento en que un vector puede ser tóxico para la célula. Nosotros necesitábamos que hiciera su función, llevar el gen que nos interesaba y sin afectar la viabilidad celular.
Prueba de fuego
–¿Cómo fue el proceso de validación, el cual finalmente reveló que el método era un potencial candidato viable para los seres humanos?
–MGH: "Además de ir más allá de validar nuestro sistema en nuestros modelos animales, teníamos que validar en monos. También, buscar un modelo que nos diera la posibilidad de validarlo en el contexto de la retina y en el contexto humano".
Ya teníamos muchos elementos resueltos. Primero, íbamos a coger células de biopsias de la piel de pacientes. Luego, íbamos a obtener células madre y organoides a partir de estos pacientes. Estos últimos se iban a modificar genéticamente con el optogen candidato número uno de nuestro estudio: el Jaws. Luego, seguía el trasplante a ratones ciegos.
De todos los optogenes, el Jaws era el que tenía el mejor perfil de expresión y toxicidad. El momento eureka llegó cuando utilizamos pulsos de luz sobre la célula pinchada y vimos que, cuando hay un pulso de luz, obtenemos una fotocorriente que corresponde a la generada por la fotoestimulación de Jaws.
–¿Ya han realizado algún trasplante?
–MGH: "Hemos trasplantado las células en diferentes modelos. El último fue en degeneración retinal completa, el más importante, en cual no hay ningún solo fotorreceptor. Las células trasplantadas con Jaws sobreviven".
–¿Qué concluye usted de este proceso?
–MGH: " La transformación optogenética de conos es un enfoque prometedor para la restauración de una alta agudeza visual, después de la degeneración completa de los fotorreceptores. Ya tenemos un vector con alta capacidad de infección, un sistema de generación de organoides altamente eficiente, un sistema de trasplantación con respuestas funcionales a la luz y una transmisión satisfactoria hacia corteza visual. Aún faltan más pruebas para que el tratamiento se concrete".
–¿Qué mensaje le da a los jóvenes farmacéuticos que apenas están en proceso de formación?
–MGH: "¡Que no tengan miedo! El miedo es paralizador. Salgan de la facultad, dejen de ser una célula madre y especialícense en lo que quieran".

Periodista Oficina de Divulgación e Información.
Destacada en:ciencias de la salud
jenniffer.jicrphmenezcordoba @ucriybd.ac.cr
Comentarios:
-
María Fernanda Moreno 2024-10-03 12:47:58Tengo un niño de 4 años con esta enfermedad, quisiera poder localizar a la doctora para que nos bride información acerca del tratamiento, tenemos las células madre de mis dos pequeños almacenadas.
Cómo se puede localizar?
Artículos Similares:
-
 La UCR invita a restaurar la Tierra durante la Semana Ambiental
La UCR invita a restaurar la Tierra durante la Semana Ambiental -
 Perseverancia: la clave para lograr estudiar lo que se ama
Perseverancia: la clave para lograr estudiar lo que se ama -
 La UCR está lista para brindar diagnósticos a pacientes con cáncer de la CCSS, pero no puede empezar
La UCR está lista para brindar diagnósticos a pacientes con cáncer de la CCSS, pero no puede empezar -
 Por primera vez, la UCR aplica una prueba para conocer el pensamiento crítico de estudiantes de …
Por primera vez, la UCR aplica una prueba para conocer el pensamiento crítico de estudiantes de …